(A)
iônicas.
(B) covalentes simples.
(C) covalentes duplas.
(D) de hidrogênio.
(E) de London.
2º) (UFES) A existência de pontes de hidrogênio só é possível entre
compostos quando a:
a) um elemento
fortemente eletropositivo ligado a um átomo de hidrogênio.
b)dois elementos, um fortemente eletropositivo e outro fortemente eletronegativo, ligados entre si.
c) um elemento fortemente eletronegativo, dotado de pares de elétrons não-compartilhados, ligado ao hidrogênio.
d) um aumento muito grande na intensidade das forças de London.
e)uma ligação química entre o hidrogênio e os elementos de transição externa.
3º) (PUC RJ) Qual força é responsável pelo fato do gelo (água sólida) flutuar no seu próprio líquido?
4º) (U. F. Santa Maria-RS) A temperatura de ebulição das substâncias normalmente aumenta à medida que
aumenta a sua massa molecular. Analisando o gráfico, que mostra a temperatura de ebulição (T.E.) de
ácidos halogenídricos, percebe-se que o HF tem um comportamento anômalo.
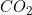 sólido) é:
sólido) é:
a) ligação covalente.
b) forças de London (entre dipolos temporários).
c) forças entre dipolos permanentes (devidos à diferença de eletronegatividade).
d) ligação coordenada.
e) ligação iônica.
3º) (UEMG) Três frascos
denominados A, B e C contêm, respectivamente, NaCl(s), HNO3(L) e CO2(g).
Em termos de forças intermoleculares, é correto afirmar que:
4º) (PUCCamp SP) Considere o texto abaixo.
b)dois elementos, um fortemente eletropositivo e outro fortemente eletronegativo, ligados entre si.
c) um elemento fortemente eletronegativo, dotado de pares de elétrons não-compartilhados, ligado ao hidrogênio.
d) um aumento muito grande na intensidade das forças de London.
e)uma ligação química entre o hidrogênio e os elementos de transição externa.
3º) (PUC RJ) Qual força é responsável pelo fato do gelo (água sólida) flutuar no seu próprio líquido?
a) ligação covalente.
b)
ponte de hidrogênio.
c)
força de Van der Waals.
d)
ligação iônica.
e)
ligação metal-metal.4º) (U. F. Santa Maria-RS) A temperatura de ebulição das substâncias normalmente aumenta à medida que
aumenta a sua massa molecular. Analisando o gráfico, que mostra a temperatura de ebulição (T.E.) de
ácidos halogenídricos, percebe-se que o HF tem um comportamento anômalo.
Esse comportamento do ácido fluorídrico pode ser atribuído a(à):
a) fortes ligações covalentes entre os átomos.
b) formação de cristais covalentes.
c) interações do tipo forças de Van der Waals.
d) interações do tipo pontes de hidrogênio.
e) fortes ligações iônicas entre os átomos.
5º) (PUC-RS) O oxigênio e o enxofre pertencem ao mesmo grupo na tabela periódica, combinam-se com o hidrogênio, formando, respectivamente, água e sulfeto de hidrogênio. Na temperatura ambiente, o sulfeto de hidrogênio é um gás e a água é liquida. Esse fato pode ser explicado considerando-se que:
a) a água é um composto iônico.
b) o sulfeto de hidrogênio é um composto covalente.
c) o sulfeto de hidrogênio é um ácido fraco.
d) ambos apresentam geometrias moleculares diferentes.
e) ambos apresentam interações intermoleculares diferentes.
6º) (UFRS) A intensificação das interações intermoleculares ocorre quando:
a) a água entra em ebulição.
b) o vapor de água sofre condensação.
c) a água, à altas temperaturas, se decompõe em hidrogênio e oxigênio.
d) o vapor de água é aquecido.
e) o gelo sofre fusão.
b) o vapor de água sofre condensação.
c) a água, à altas temperaturas, se decompõe em hidrogênio e oxigênio.
d) o vapor de água é aquecido.
e) o gelo sofre fusão.
LIGAÇÕES DE VAN DER WAALS
1º) (UFSE) Quando um gás nobre sofre liquefação seus átomos ficam unidos
uns aos outros por ligações químicas denominadas?
a)
covalentes
b) iônicas
c) metálicas
d) pontes de
hidrogênio
e) Van der
Waals
2º) (Unip-SP) O principal tipo de forças atrativas que deve
ser vencida para sublimar o gelo seco (a) ligação covalente.
b) forças de London (entre dipolos temporários).
c) forças entre dipolos permanentes (devidos à diferença de eletronegatividade).
d) ligação coordenada.
e) ligação iônica.
a)em A observa-se força dipolo-dipolo.
b)em B observa-se força eletrostática.
c)em C observa-se força de Van der Waals.
d)em A e B os compostos são apolares
e)em B e C os compostos são polares
4º) (PUCCamp SP) Considere o texto abaixo.
“Nos icebergs, as moléculas polares da água associam-se por _____ ; no gelo seco, as moléculas apolares do dióxido de carbono unem-se por ______ . Conseqüentemente, a 1,0 atmosfera de pressão, é possível prever que a mudança de estado de agregação do gelo ocorra a uma temperatura _____ do que a do gelo seco.”
Para completá-lo corretamente, os espaços devem ser substituídos, respectivamente, por:
a) forças de London; ponte de hidrogênio; menor
b) ponte de hidrogênio; forças de Van der Waals; maior
c) forças de Vander waals; ponte de hidrogênio ; menor
d) forças de Van der Waals; forças de London; menor
e) Ponte de Hidrogênio; Ponte de hidrogênio; maior
Nenhum comentário:
Postar um comentário