CONCENTRAÇÃO MOLAR OU CONCENTRAÇÃO EM QUANTIDADE DE MATÉRIA
1º) 200 ml de uma solução contêm 5,3 g de carbonato de sódio (Na2CO3). Calcule a molaridade dessa solução em relação ao sal e aos íons Na+ e CO32- . Dados: Na = 23 C = 12 O = 16.
a) 0,25 molar / 0,5 molar / 0,2 molar
b) 0,5 molar / 0,25 molar / 0,25 molar
c) 0,2 molar / 0,5 molar / 0,5 molar
d) 0,25 molar / 0,1 molar / 0,5 molar
e) 0,25 molar / 0,5 molar / 0,25 molar
sexta-feira, 10 de novembro de 2017
quinta-feira, 9 de novembro de 2017
TIPOS DE REAÇÕES
1º) Analise as quatro reações químicas abaixo e marque a alternativa que corresponde ao tipo de reação, respectivamente.
1) 8 H2S + 8 Cl2 => S8 + 16 HCl
2) 6 H3BO3 => H4B6O11 + 7 H2O
3) P4 + 5 O2 2 P2O5
4) 3 BaCl + Al2(SO4)3 3 BaSO4 + 2AlCl3
a) Decomposição, simples troca, dupla troca, síntese
b) Dupla troca, decomposição, síntese, simples troca
c) Simples troca, decomposição, síntese, dupla troca
d) Síntese, simples troca, decomposição, dupla troca
e) Dupla troca, síntese, decomposição, simples troca
1) 8 H2S + 8 Cl2 => S8 + 16 HCl
2) 6 H3BO3 => H4B6O11 + 7 H2O
3) P4 + 5 O2 2 P2O5
4) 3 BaCl + Al2(SO4)3 3 BaSO4 + 2AlCl3
a) Decomposição, simples troca, dupla troca, síntese
b) Dupla troca, decomposição, síntese, simples troca
c) Simples troca, decomposição, síntese, dupla troca
d) Síntese, simples troca, decomposição, dupla troca
e) Dupla troca, síntese, decomposição, simples troca
PRINCIPAIS CARACTERÍSTICAS DO ÁTOMO E SUAS RELAÇÕES
1º) As explosões atômicas de Hiroshima e Nagasaki mataram instantaneamente 150 mil pessoas. Nos dias seguintes, outros milhares tiveram manchas na pele, queda de cabelos e gengivas sangrando, e acabaram morrendo devido aos efeitos da radiação. Essa devastação foi causada por um fenômeno chamado fissão
nuclear. Na bomba de Hiroshima, o material que sofreu a fissão era o urânio-235. Tendo em vista essas informações, marque a alternativa correta.
a) 235 é a soma de prótons e nêutrons desse átomo.
b) 235 é a diferença de prótons e nêutrons desse átomo.
c) 235 é a soma de prótons e elétrons desse átomo.
d) 235 é a quantidade de partículas alfa () emitidas na fissão.
e) 235 é a quantidade de partículas beta (ß) emitidas na fissão.
nuclear. Na bomba de Hiroshima, o material que sofreu a fissão era o urânio-235. Tendo em vista essas informações, marque a alternativa correta.
a) 235 é a soma de prótons e nêutrons desse átomo.
b) 235 é a diferença de prótons e nêutrons desse átomo.
c) 235 é a soma de prótons e elétrons desse átomo.
d) 235 é a quantidade de partículas alfa () emitidas na fissão.
e) 235 é a quantidade de partículas beta (ß) emitidas na fissão.
terça-feira, 7 de novembro de 2017
FORMULAS MOLECULARES
1º) O nitrato de cálcio numa dada reação química tem fórmula 3Ca(NO3)2. Quantos átomos de cada elemento existem nessa fórmula, respectivamente?
a) 3, 2, 3 d) 1, 3, 6
b) 3, 2, 6 e) 3, 6, 18
c) 6, 6, 18
a) 3, 2, 3 d) 1, 3, 6
b) 3, 2, 6 e) 3, 6, 18
c) 6, 6, 18
DISTRIBUIÇÃO ELETRÔNICA
1º) Da concepção dos gregos Leucipo e Demócrito à mecânica quântica e ao princípio da incerteza de Heisenberg, o conhecimento sobre os átomos percorreu uma longa trajetória. As características de partícula-onda atribuída ao elétron ainda parecem ser incompreensíveis para a grande maioria da
humanidade.
O modelo atômico acima representa um determinado átomo. Supondo-se que esse átomo possa ser excitado, marque a alternativa que corresponde à configuração eletrônica do seu íon de carga negativa monovalente.
a) 1s2 2s2 2p6 3s2 3p5 d) 1s2 2s2 2p6 3s2 3p6 4s1
b) 1s2 2s2 2p6 3s2 3p3 4s2 e) 1s2 2s2 2p6 3s2 3p1
c) 1s2 2s2 2p6 3s2 3p6
sábado, 4 de novembro de 2017
BALANCEAMENTO DE EQUAÇÕES QUÍMICAS
EQUAÇÃO IÔNICA
1º)Uma das formas de determinar a concentração de íons cálcio em uma solução aquosa é precipitá-los sob forma de oxalato de cálcio (CaC2O4). Em seguida, dissolve-se o precipitado com ácido sulfúrico e titulam-se os íons oxalato com permanganato de potássio. A equação da reação desse processo, não balanceada, é a seguinte:
no sentido de frear o aquecimento global. Um desses gases ganha especial destaque, por ser, seguramente, aquele que mais emitimos na atmosfera: o dióxido de carbono (CO2). A grande quantidade
de CO2 vem da produção de energia obtida principalmente pela queima de combustíveis orgânicos, conforme reação genérica abaixo.
Considerando n igual a 4, determine a quantidade de CO2
produzida de acordo com a equação genérica acima. Dados: C =
12 O = 16 H = 1
a) 176 g d) 18 g
b) 44 g e) 88 g
c) 100 g
3º) Com base na equação química abaixo, marque a alternativa
correta.
2ZnS + 3 O2 ==> 2 ZnO + 2 SO2
a) O oxigênio e o sulfeto de zinco são os produtos desta reação.
b) A equação química não está balanceada.
c) O sulfeto de zinco e o óxido de enxofre são os reagentes
desta reação.
d) A equação química está balanceada.
e) A soma dos mols dos reagentes é igual a três.
1º)Uma das formas de determinar a concentração de íons cálcio em uma solução aquosa é precipitá-los sob forma de oxalato de cálcio (CaC2O4). Em seguida, dissolve-se o precipitado com ácido sulfúrico e titulam-se os íons oxalato com permanganato de potássio. A equação da reação desse processo, não balanceada, é a seguinte:
...C2O 2- (aq) + ...MnO - (aq) + ...H+(aq) ® ...Mn2+ (aq) +
4 4
...CO2 (g) + ...H2O(l)
Nessa reação, a proporção em
mol entre íons oxalato e permanganato que reagem é, respectivamente, de
(A) 1:1
(B) 1:2
(C) 1:5
(D) 5:1
(E) 5:2
2º) O Protocolo de Kyoto é um documento que compromete os países signatários com a implantação de projetos que têm como objetivo a redução de emissão dos gases responsáveis pelo efeito estufa,no sentido de frear o aquecimento global. Um desses gases ganha especial destaque, por ser, seguramente, aquele que mais emitimos na atmosfera: o dióxido de carbono (CO2). A grande quantidade
de CO2 vem da produção de energia obtida principalmente pela queima de combustíveis orgânicos, conforme reação genérica abaixo.
Considerando n igual a 4, determine a quantidade de CO2
produzida de acordo com a equação genérica acima. Dados: C =
12 O = 16 H = 1
a) 176 g d) 18 g
b) 44 g e) 88 g
c) 100 g
3º) Com base na equação química abaixo, marque a alternativa
correta.
2ZnS + 3 O2 ==> 2 ZnO + 2 SO2
a) O oxigênio e o sulfeto de zinco são os produtos desta reação.
b) A equação química não está balanceada.
c) O sulfeto de zinco e o óxido de enxofre são os reagentes
desta reação.
d) A equação química está balanceada.
e) A soma dos mols dos reagentes é igual a três.
NÚMEROS DE OXIDAÇÃO
1º) Hidretos metálicos são compostos em que o número de
oxidação do elemento hidrogênio é
(A)
-2
(B)
-1
(C)
zero
(D)
+ 1
(E) + 2
CLASSIFICAÇÃO DOS ÓXIDOS
ÓXIDOS BÁSICOS
1º) Considere os seguintes óxidos:
1º) Considere os seguintes óxidos:
I. CaO.
II. MgO.
IIIP2O5.
IV.CO2.
Suponha que cada
um desses óxidos foi misturado a água destilada. Na mistura obtida, foram
colocadas gotas de solução de fenolftaleína. Deve ter sido observado o
aparecimento de cor avermelhada somente nas misturas obtidas com os óxidos
( A) I e II.
(B)
I e III.
(C)
II e III.
(D)
II e IV.
(E) III e IV.
LIGAÇÃO METÁLICA
1º) “Mar” de elétrons
livres é uma expressão que se aplica à estrutura de certos sólidos como, por
exemplo, o
(A) gelo.
(B) ouro.
(C) cloreto de sódio.
(D) enxofre rômbico.
(E) fósforo vermelho.
RERESPOSTA: Esse processo continua indefinidamente e, com isso, o metal se torna um aglomerado de átomos neutros e cátions mergulhados em uma nuvem ou mar de elétrons livres. É exatamente essa nuvem que mantém os metais unidos, formando a ligação metálica.
FORÇAS INTERMOLECULARES
1º) O fluoreto de hidrogênio nos estados líquido e
sólido é formado por cadeias poliméricas em que moléculas HF estão unidas umas
às outras por ligações
(A)
iônicas.
(B) covalentes simples.
(C) covalentes duplas.
(D) de hidrogênio.
(E) de London.
2º) (UFES) A existência de pontes de hidrogênio só é possível entre
compostos quando a:
a) um elemento
fortemente eletropositivo ligado a um átomo de hidrogênio.
b)dois elementos, um fortemente eletropositivo e outro fortemente eletronegativo, ligados entre si.
c) um elemento fortemente eletronegativo, dotado de pares de elétrons não-compartilhados, ligado ao hidrogênio.
d) um aumento muito grande na intensidade das forças de London.
e)uma ligação química entre o hidrogênio e os elementos de transição externa.
3º) (PUC RJ) Qual força é responsável pelo fato do gelo (água sólida) flutuar no seu próprio líquido?
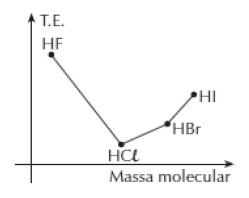
4º) (U. F. Santa Maria-RS) A temperatura de ebulição das substâncias normalmente aumenta à medida que
aumenta a sua massa molecular. Analisando o gráfico, que mostra a temperatura de ebulição (T.E.) de
ácidos halogenídricos, percebe-se que o HF tem um comportamento anômalo.
 sólido) é:
sólido) é:
a) ligação covalente.
b) forças de London (entre dipolos temporários).
c) forças entre dipolos permanentes (devidos à diferença de eletronegatividade).
d) ligação coordenada.
e) ligação iônica.
3º) (UEMG) Três frascos
denominados A, B e C contêm, respectivamente, NaCl(s), HNO3(L) e CO2(g).
Em termos de forças intermoleculares, é correto afirmar que:
4º) (PUCCamp SP) Considere o texto abaixo.
b)dois elementos, um fortemente eletropositivo e outro fortemente eletronegativo, ligados entre si.
c) um elemento fortemente eletronegativo, dotado de pares de elétrons não-compartilhados, ligado ao hidrogênio.
d) um aumento muito grande na intensidade das forças de London.
e)uma ligação química entre o hidrogênio e os elementos de transição externa.
3º) (PUC RJ) Qual força é responsável pelo fato do gelo (água sólida) flutuar no seu próprio líquido?
a) ligação covalente.
b)
ponte de hidrogênio.
c)
força de Van der Waals.
d)
ligação iônica.
e)
ligação metal-metal.4º) (U. F. Santa Maria-RS) A temperatura de ebulição das substâncias normalmente aumenta à medida que
aumenta a sua massa molecular. Analisando o gráfico, que mostra a temperatura de ebulição (T.E.) de
ácidos halogenídricos, percebe-se que o HF tem um comportamento anômalo.
Esse comportamento do ácido fluorídrico pode ser atribuído a(à):
a) fortes ligações covalentes entre os átomos.
b) formação de cristais covalentes.
c) interações do tipo forças de Van der Waals.
d) interações do tipo pontes de hidrogênio.
e) fortes ligações iônicas entre os átomos.
5º) (PUC-RS) O oxigênio e o enxofre pertencem ao mesmo grupo na tabela periódica, combinam-se com o hidrogênio, formando, respectivamente, água e sulfeto de hidrogênio. Na temperatura ambiente, o sulfeto de hidrogênio é um gás e a água é liquida. Esse fato pode ser explicado considerando-se que:
a) a água é um composto iônico.
b) o sulfeto de hidrogênio é um composto covalente.
c) o sulfeto de hidrogênio é um ácido fraco.
d) ambos apresentam geometrias moleculares diferentes.
e) ambos apresentam interações intermoleculares diferentes.
6º) (UFRS) A intensificação das interações intermoleculares ocorre quando:
a) a água entra em ebulição.
b) o vapor de água sofre condensação.
c) a água, à altas temperaturas, se decompõe em hidrogênio e oxigênio.
d) o vapor de água é aquecido.
e) o gelo sofre fusão.
b) o vapor de água sofre condensação.
c) a água, à altas temperaturas, se decompõe em hidrogênio e oxigênio.
d) o vapor de água é aquecido.
e) o gelo sofre fusão.
LIGAÇÕES DE VAN DER WAALS
1º) (UFSE) Quando um gás nobre sofre liquefação seus átomos ficam unidos
uns aos outros por ligações químicas denominadas?
a)
covalentes
b) iônicas
c) metálicas
d) pontes de
hidrogênio
e) Van der
Waals
2º) (Unip-SP) O principal tipo de forças atrativas que deve
ser vencida para sublimar o gelo seco (a) ligação covalente.
b) forças de London (entre dipolos temporários).
c) forças entre dipolos permanentes (devidos à diferença de eletronegatividade).
d) ligação coordenada.
e) ligação iônica.
a)em A observa-se força dipolo-dipolo.
b)em B observa-se força eletrostática.
c)em C observa-se força de Van der Waals.
d)em A e B os compostos são apolares
e)em B e C os compostos são polares
4º) (PUCCamp SP) Considere o texto abaixo.
“Nos icebergs, as moléculas polares da água associam-se por _____ ; no gelo seco, as moléculas apolares do dióxido de carbono unem-se por ______ . Conseqüentemente, a 1,0 atmosfera de pressão, é possível prever que a mudança de estado de agregação do gelo ocorra a uma temperatura _____ do que a do gelo seco.”
Para completá-lo corretamente, os espaços devem ser substituídos, respectivamente, por:
a) forças de London; ponte de hidrogênio; menor
b) ponte de hidrogênio; forças de Van der Waals; maior
c) forças de Vander waals; ponte de hidrogênio ; menor
d) forças de Van der Waals; forças de London; menor
e) Ponte de Hidrogênio; Ponte de hidrogênio; maior
GEOMETRIA MOLECULAR
1º) Com base na teoria
da repulsão dos pares eletrônicos da camada de valência, prevê-se que a
geometria da molécula do sulfeto de hidrogênio
seja
(A)
linear.
(B)
angular.
(C)
trigonal plana.
(D)
tetraédrica.
(E) hexagonal.
sexta-feira, 3 de novembro de 2017
TABELA PERIÓDICA
1º) Comparando átomos
dos elementos nitrogênio e flúor no estado fundamental, pode-se afirmar que
(A)
estão no mesmo período da tabela periódica.
(B)
têm o mesmo número de elétrons de valência.
(C)
têm a mesma eletronegatividade.
(D)
têm a mesma carga
nuclear.
(E)
estão no mesmo grupo da tabela periódica.
2º) Analise as afirmativas abaixo e marque, em seguida, a alternativa que corresponde aos elementos químicos, respectivamente.
I. Eles são a maioria dos elementos da tabela Periódica. São maleáveis, dúcteis e bons condutores de calor, com exceção do Hg.
II. São os mais abundantes na natureza. Não são bons condutores de calor e eletricidade, não são maleáveis e dúcteis.
III. São elementos cuja característica mais importante é a inércia química.
a) Gases nobres, metais, não-metais
b) Não-metais, metais, gases nobres
c) Metais, não-metais, gases nobres
d) Gases nobres, não-metais, metais
e) Não-metais, gases nobres, não-metais
2º) Analise as afirmativas abaixo e marque, em seguida, a alternativa que corresponde aos elementos químicos, respectivamente.
I. Eles são a maioria dos elementos da tabela Periódica. São maleáveis, dúcteis e bons condutores de calor, com exceção do Hg.
II. São os mais abundantes na natureza. Não são bons condutores de calor e eletricidade, não são maleáveis e dúcteis.
III. São elementos cuja característica mais importante é a inércia química.
a) Gases nobres, metais, não-metais
b) Não-metais, metais, gases nobres
c) Metais, não-metais, gases nobres
d) Gases nobres, não-metais, metais
e) Não-metais, gases nobres, não-metais
EVOLUÇÃO DOS MODELOS ATÔMICOS
1º) Compostos
de estrôncio como o nitrato de estrôncio são empregados em fogos de artifício
pois, quando aquecidos, emitem luz de cor vermelha intensa.
A emissão de luz
vermelha é explicada pela:
(A)
emissão de radiação beta pelos núcleos do átomo de
estrôncio.
(B)
decomposição dos íons nitrato em nitrogênio e
oxigênio.
(C)
cor dos átomos de estrôncio metálico, que é vermelha.
(D)
transição de níveis de energia de elétrons do
estrôncio.
(E)
alta solubilidade dos compostos de estrôncio em
água.
NÚMERO ATÔMICO, NÚMERO DE MASSA E ELEMENTO QUÍMICO
1º) O núcleo atômico
I. tem volume
praticamente igual ao do átomo.
II. é eletricamente neutro.
III. contém prótons e nêutrons.
É correto o
que se afirma APENAS em
(A)
I.
(B)
II.
(C)
III.
(D)
I e II.
(E)
II e III.
2º) O número de prótons e o número de elétrons do íon estrôncio no nitrato de estrôncio são, respectivamente,
2º) O número de prótons e o número de elétrons do íon estrôncio no nitrato de estrôncio são, respectivamente,
(A) 36 e 38.
(B) 37 e 38.
(C) 38 e 38.
(D) 38 e 37.
(E) 38 e 36.
DENSIDADE DE LÍQUIDOS
1º) Uma forma de verificar se o álcool comercializado em
postos de abastecimento de combustíveis foi adulterado com adição de água é
coletar uma amostra do combustível e
(A)
determinar a sua densidade com um densímetro.
(B) medir o seu volume
com um balão volumétrico.
(C) determinar sua
massa em uma balança analítica.
(D) observar se ela
muda a cor do papel de tornassol.
(E) submetê-la a uma
filtração com papel de filtro.
quarta-feira, 1 de novembro de 2017
HISTÓRIA DA QUIMICA
1º) O “nascimento” da chamada “Química Moderna” está
diretamente relacionado com a publicação da obra Traité Élémentaire de Chimie (Tratado Elementar de Química),
escrita por
(A) Boyle.
(B) Lavoisier.
(C) Dalton.
(D) Wöhler.
(E) Berzelius.
RESPOSTA: Traité élémentaire de chimie (tratado elementar de química) é um livro texto escrito por Antoine Lavoisier e publicado em 1789.[1] [2]A obra é considerada o primeiro livro texto de química devido ao uso sistemático de instrumentos de precisão, metodologia rigorosa nos experimentos e por negar a teoria do flogisto postulado pela alquimia. O livro também contém uma tabela com os 33 elementos assim definidos por Lavoisier na época assim como uma definição de substância simples que foi fundamental para o desenvolvimento da química.[3][4]
Assinar:
Comentários (Atom)