CONCENTRAÇÃO MOLAR OU CONCENTRAÇÃO EM QUANTIDADE DE MATÉRIA
1º) 200 ml de uma solução contêm 5,3 g de carbonato de sódio (Na2CO3). Calcule a molaridade dessa solução em relação ao sal e aos íons Na+ e CO32- . Dados: Na = 23 C = 12 O = 16.
a) 0,25 molar / 0,5 molar / 0,2 molar
b) 0,5 molar / 0,25 molar / 0,25 molar
c) 0,2 molar / 0,5 molar / 0,5 molar
d) 0,25 molar / 0,1 molar / 0,5 molar
e) 0,25 molar / 0,5 molar / 0,25 molar
sexta-feira, 10 de novembro de 2017
quinta-feira, 9 de novembro de 2017
TIPOS DE REAÇÕES
1º) Analise as quatro reações químicas abaixo e marque a alternativa que corresponde ao tipo de reação, respectivamente.
1) 8 H2S + 8 Cl2 => S8 + 16 HCl
2) 6 H3BO3 => H4B6O11 + 7 H2O
3) P4 + 5 O2 2 P2O5
4) 3 BaCl + Al2(SO4)3 3 BaSO4 + 2AlCl3
a) Decomposição, simples troca, dupla troca, síntese
b) Dupla troca, decomposição, síntese, simples troca
c) Simples troca, decomposição, síntese, dupla troca
d) Síntese, simples troca, decomposição, dupla troca
e) Dupla troca, síntese, decomposição, simples troca
1) 8 H2S + 8 Cl2 => S8 + 16 HCl
2) 6 H3BO3 => H4B6O11 + 7 H2O
3) P4 + 5 O2 2 P2O5
4) 3 BaCl + Al2(SO4)3 3 BaSO4 + 2AlCl3
a) Decomposição, simples troca, dupla troca, síntese
b) Dupla troca, decomposição, síntese, simples troca
c) Simples troca, decomposição, síntese, dupla troca
d) Síntese, simples troca, decomposição, dupla troca
e) Dupla troca, síntese, decomposição, simples troca
PRINCIPAIS CARACTERÍSTICAS DO ÁTOMO E SUAS RELAÇÕES
1º) As explosões atômicas de Hiroshima e Nagasaki mataram instantaneamente 150 mil pessoas. Nos dias seguintes, outros milhares tiveram manchas na pele, queda de cabelos e gengivas sangrando, e acabaram morrendo devido aos efeitos da radiação. Essa devastação foi causada por um fenômeno chamado fissão
nuclear. Na bomba de Hiroshima, o material que sofreu a fissão era o urânio-235. Tendo em vista essas informações, marque a alternativa correta.
a) 235 é a soma de prótons e nêutrons desse átomo.
b) 235 é a diferença de prótons e nêutrons desse átomo.
c) 235 é a soma de prótons e elétrons desse átomo.
d) 235 é a quantidade de partículas alfa () emitidas na fissão.
e) 235 é a quantidade de partículas beta (ß) emitidas na fissão.
nuclear. Na bomba de Hiroshima, o material que sofreu a fissão era o urânio-235. Tendo em vista essas informações, marque a alternativa correta.
a) 235 é a soma de prótons e nêutrons desse átomo.
b) 235 é a diferença de prótons e nêutrons desse átomo.
c) 235 é a soma de prótons e elétrons desse átomo.
d) 235 é a quantidade de partículas alfa () emitidas na fissão.
e) 235 é a quantidade de partículas beta (ß) emitidas na fissão.
terça-feira, 7 de novembro de 2017
FORMULAS MOLECULARES
1º) O nitrato de cálcio numa dada reação química tem fórmula 3Ca(NO3)2. Quantos átomos de cada elemento existem nessa fórmula, respectivamente?
a) 3, 2, 3 d) 1, 3, 6
b) 3, 2, 6 e) 3, 6, 18
c) 6, 6, 18
a) 3, 2, 3 d) 1, 3, 6
b) 3, 2, 6 e) 3, 6, 18
c) 6, 6, 18
DISTRIBUIÇÃO ELETRÔNICA
1º) Da concepção dos gregos Leucipo e Demócrito à mecânica quântica e ao princípio da incerteza de Heisenberg, o conhecimento sobre os átomos percorreu uma longa trajetória. As características de partícula-onda atribuída ao elétron ainda parecem ser incompreensíveis para a grande maioria da
humanidade.
O modelo atômico acima representa um determinado átomo. Supondo-se que esse átomo possa ser excitado, marque a alternativa que corresponde à configuração eletrônica do seu íon de carga negativa monovalente.
a) 1s2 2s2 2p6 3s2 3p5 d) 1s2 2s2 2p6 3s2 3p6 4s1
b) 1s2 2s2 2p6 3s2 3p3 4s2 e) 1s2 2s2 2p6 3s2 3p1
c) 1s2 2s2 2p6 3s2 3p6
sábado, 4 de novembro de 2017
BALANCEAMENTO DE EQUAÇÕES QUÍMICAS
EQUAÇÃO IÔNICA
1º)Uma das formas de determinar a concentração de íons cálcio em uma solução aquosa é precipitá-los sob forma de oxalato de cálcio (CaC2O4). Em seguida, dissolve-se o precipitado com ácido sulfúrico e titulam-se os íons oxalato com permanganato de potássio. A equação da reação desse processo, não balanceada, é a seguinte:
no sentido de frear o aquecimento global. Um desses gases ganha especial destaque, por ser, seguramente, aquele que mais emitimos na atmosfera: o dióxido de carbono (CO2). A grande quantidade
de CO2 vem da produção de energia obtida principalmente pela queima de combustíveis orgânicos, conforme reação genérica abaixo.
Considerando n igual a 4, determine a quantidade de CO2
produzida de acordo com a equação genérica acima. Dados: C =
12 O = 16 H = 1
a) 176 g d) 18 g
b) 44 g e) 88 g
c) 100 g
3º) Com base na equação química abaixo, marque a alternativa
correta.
2ZnS + 3 O2 ==> 2 ZnO + 2 SO2
a) O oxigênio e o sulfeto de zinco são os produtos desta reação.
b) A equação química não está balanceada.
c) O sulfeto de zinco e o óxido de enxofre são os reagentes
desta reação.
d) A equação química está balanceada.
e) A soma dos mols dos reagentes é igual a três.
1º)Uma das formas de determinar a concentração de íons cálcio em uma solução aquosa é precipitá-los sob forma de oxalato de cálcio (CaC2O4). Em seguida, dissolve-se o precipitado com ácido sulfúrico e titulam-se os íons oxalato com permanganato de potássio. A equação da reação desse processo, não balanceada, é a seguinte:
...C2O 2- (aq) + ...MnO - (aq) + ...H+(aq) ® ...Mn2+ (aq) +
4 4
...CO2 (g) + ...H2O(l)
Nessa reação, a proporção em
mol entre íons oxalato e permanganato que reagem é, respectivamente, de
(A) 1:1
(B) 1:2
(C) 1:5
(D) 5:1
(E) 5:2
2º) O Protocolo de Kyoto é um documento que compromete os países signatários com a implantação de projetos que têm como objetivo a redução de emissão dos gases responsáveis pelo efeito estufa,no sentido de frear o aquecimento global. Um desses gases ganha especial destaque, por ser, seguramente, aquele que mais emitimos na atmosfera: o dióxido de carbono (CO2). A grande quantidade
de CO2 vem da produção de energia obtida principalmente pela queima de combustíveis orgânicos, conforme reação genérica abaixo.
Considerando n igual a 4, determine a quantidade de CO2
produzida de acordo com a equação genérica acima. Dados: C =
12 O = 16 H = 1
a) 176 g d) 18 g
b) 44 g e) 88 g
c) 100 g
3º) Com base na equação química abaixo, marque a alternativa
correta.
2ZnS + 3 O2 ==> 2 ZnO + 2 SO2
a) O oxigênio e o sulfeto de zinco são os produtos desta reação.
b) A equação química não está balanceada.
c) O sulfeto de zinco e o óxido de enxofre são os reagentes
desta reação.
d) A equação química está balanceada.
e) A soma dos mols dos reagentes é igual a três.
NÚMEROS DE OXIDAÇÃO
1º) Hidretos metálicos são compostos em que o número de
oxidação do elemento hidrogênio é
(A)
-2
(B)
-1
(C)
zero
(D)
+ 1
(E) + 2
CLASSIFICAÇÃO DOS ÓXIDOS
ÓXIDOS BÁSICOS
1º) Considere os seguintes óxidos:
1º) Considere os seguintes óxidos:
I. CaO.
II. MgO.
IIIP2O5.
IV.CO2.
Suponha que cada
um desses óxidos foi misturado a água destilada. Na mistura obtida, foram
colocadas gotas de solução de fenolftaleína. Deve ter sido observado o
aparecimento de cor avermelhada somente nas misturas obtidas com os óxidos
( A) I e II.
(B)
I e III.
(C)
II e III.
(D)
II e IV.
(E) III e IV.
LIGAÇÃO METÁLICA
1º) “Mar” de elétrons
livres é uma expressão que se aplica à estrutura de certos sólidos como, por
exemplo, o
(A) gelo.
(B) ouro.
(C) cloreto de sódio.
(D) enxofre rômbico.
(E) fósforo vermelho.
RERESPOSTA: Esse processo continua indefinidamente e, com isso, o metal se torna um aglomerado de átomos neutros e cátions mergulhados em uma nuvem ou mar de elétrons livres. É exatamente essa nuvem que mantém os metais unidos, formando a ligação metálica.
FORÇAS INTERMOLECULARES
1º) O fluoreto de hidrogênio nos estados líquido e
sólido é formado por cadeias poliméricas em que moléculas HF estão unidas umas
às outras por ligações
(A)
iônicas.
(B) covalentes simples.
(C) covalentes duplas.
(D) de hidrogênio.
(E) de London.
2º) (UFES) A existência de pontes de hidrogênio só é possível entre
compostos quando a:
a) um elemento
fortemente eletropositivo ligado a um átomo de hidrogênio.
b)dois elementos, um fortemente eletropositivo e outro fortemente eletronegativo, ligados entre si.
c) um elemento fortemente eletronegativo, dotado de pares de elétrons não-compartilhados, ligado ao hidrogênio.
d) um aumento muito grande na intensidade das forças de London.
e)uma ligação química entre o hidrogênio e os elementos de transição externa.
3º) (PUC RJ) Qual força é responsável pelo fato do gelo (água sólida) flutuar no seu próprio líquido?
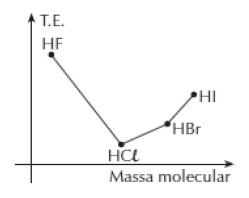
4º) (U. F. Santa Maria-RS) A temperatura de ebulição das substâncias normalmente aumenta à medida que
aumenta a sua massa molecular. Analisando o gráfico, que mostra a temperatura de ebulição (T.E.) de
ácidos halogenídricos, percebe-se que o HF tem um comportamento anômalo.
 sólido) é:
sólido) é:
a) ligação covalente.
b) forças de London (entre dipolos temporários).
c) forças entre dipolos permanentes (devidos à diferença de eletronegatividade).
d) ligação coordenada.
e) ligação iônica.
3º) (UEMG) Três frascos
denominados A, B e C contêm, respectivamente, NaCl(s), HNO3(L) e CO2(g).
Em termos de forças intermoleculares, é correto afirmar que:
4º) (PUCCamp SP) Considere o texto abaixo.
b)dois elementos, um fortemente eletropositivo e outro fortemente eletronegativo, ligados entre si.
c) um elemento fortemente eletronegativo, dotado de pares de elétrons não-compartilhados, ligado ao hidrogênio.
d) um aumento muito grande na intensidade das forças de London.
e)uma ligação química entre o hidrogênio e os elementos de transição externa.
3º) (PUC RJ) Qual força é responsável pelo fato do gelo (água sólida) flutuar no seu próprio líquido?
a) ligação covalente.
b)
ponte de hidrogênio.
c)
força de Van der Waals.
d)
ligação iônica.
e)
ligação metal-metal.4º) (U. F. Santa Maria-RS) A temperatura de ebulição das substâncias normalmente aumenta à medida que
aumenta a sua massa molecular. Analisando o gráfico, que mostra a temperatura de ebulição (T.E.) de
ácidos halogenídricos, percebe-se que o HF tem um comportamento anômalo.
Esse comportamento do ácido fluorídrico pode ser atribuído a(à):
a) fortes ligações covalentes entre os átomos.
b) formação de cristais covalentes.
c) interações do tipo forças de Van der Waals.
d) interações do tipo pontes de hidrogênio.
e) fortes ligações iônicas entre os átomos.
5º) (PUC-RS) O oxigênio e o enxofre pertencem ao mesmo grupo na tabela periódica, combinam-se com o hidrogênio, formando, respectivamente, água e sulfeto de hidrogênio. Na temperatura ambiente, o sulfeto de hidrogênio é um gás e a água é liquida. Esse fato pode ser explicado considerando-se que:
a) a água é um composto iônico.
b) o sulfeto de hidrogênio é um composto covalente.
c) o sulfeto de hidrogênio é um ácido fraco.
d) ambos apresentam geometrias moleculares diferentes.
e) ambos apresentam interações intermoleculares diferentes.
6º) (UFRS) A intensificação das interações intermoleculares ocorre quando:
a) a água entra em ebulição.
b) o vapor de água sofre condensação.
c) a água, à altas temperaturas, se decompõe em hidrogênio e oxigênio.
d) o vapor de água é aquecido.
e) o gelo sofre fusão.
b) o vapor de água sofre condensação.
c) a água, à altas temperaturas, se decompõe em hidrogênio e oxigênio.
d) o vapor de água é aquecido.
e) o gelo sofre fusão.
LIGAÇÕES DE VAN DER WAALS
1º) (UFSE) Quando um gás nobre sofre liquefação seus átomos ficam unidos
uns aos outros por ligações químicas denominadas?
a)
covalentes
b) iônicas
c) metálicas
d) pontes de
hidrogênio
e) Van der
Waals
2º) (Unip-SP) O principal tipo de forças atrativas que deve
ser vencida para sublimar o gelo seco (a) ligação covalente.
b) forças de London (entre dipolos temporários).
c) forças entre dipolos permanentes (devidos à diferença de eletronegatividade).
d) ligação coordenada.
e) ligação iônica.
a)em A observa-se força dipolo-dipolo.
b)em B observa-se força eletrostática.
c)em C observa-se força de Van der Waals.
d)em A e B os compostos são apolares
e)em B e C os compostos são polares
4º) (PUCCamp SP) Considere o texto abaixo.
“Nos icebergs, as moléculas polares da água associam-se por _____ ; no gelo seco, as moléculas apolares do dióxido de carbono unem-se por ______ . Conseqüentemente, a 1,0 atmosfera de pressão, é possível prever que a mudança de estado de agregação do gelo ocorra a uma temperatura _____ do que a do gelo seco.”
Para completá-lo corretamente, os espaços devem ser substituídos, respectivamente, por:
a) forças de London; ponte de hidrogênio; menor
b) ponte de hidrogênio; forças de Van der Waals; maior
c) forças de Vander waals; ponte de hidrogênio ; menor
d) forças de Van der Waals; forças de London; menor
e) Ponte de Hidrogênio; Ponte de hidrogênio; maior
GEOMETRIA MOLECULAR
1º) Com base na teoria
da repulsão dos pares eletrônicos da camada de valência, prevê-se que a
geometria da molécula do sulfeto de hidrogênio
seja
(A)
linear.
(B)
angular.
(C)
trigonal plana.
(D)
tetraédrica.
(E) hexagonal.
sexta-feira, 3 de novembro de 2017
TABELA PERIÓDICA
1º) Comparando átomos
dos elementos nitrogênio e flúor no estado fundamental, pode-se afirmar que
(A)
estão no mesmo período da tabela periódica.
(B)
têm o mesmo número de elétrons de valência.
(C)
têm a mesma eletronegatividade.
(D)
têm a mesma carga
nuclear.
(E)
estão no mesmo grupo da tabela periódica.
2º) Analise as afirmativas abaixo e marque, em seguida, a alternativa que corresponde aos elementos químicos, respectivamente.
I. Eles são a maioria dos elementos da tabela Periódica. São maleáveis, dúcteis e bons condutores de calor, com exceção do Hg.
II. São os mais abundantes na natureza. Não são bons condutores de calor e eletricidade, não são maleáveis e dúcteis.
III. São elementos cuja característica mais importante é a inércia química.
a) Gases nobres, metais, não-metais
b) Não-metais, metais, gases nobres
c) Metais, não-metais, gases nobres
d) Gases nobres, não-metais, metais
e) Não-metais, gases nobres, não-metais
2º) Analise as afirmativas abaixo e marque, em seguida, a alternativa que corresponde aos elementos químicos, respectivamente.
I. Eles são a maioria dos elementos da tabela Periódica. São maleáveis, dúcteis e bons condutores de calor, com exceção do Hg.
II. São os mais abundantes na natureza. Não são bons condutores de calor e eletricidade, não são maleáveis e dúcteis.
III. São elementos cuja característica mais importante é a inércia química.
a) Gases nobres, metais, não-metais
b) Não-metais, metais, gases nobres
c) Metais, não-metais, gases nobres
d) Gases nobres, não-metais, metais
e) Não-metais, gases nobres, não-metais
EVOLUÇÃO DOS MODELOS ATÔMICOS
1º) Compostos
de estrôncio como o nitrato de estrôncio são empregados em fogos de artifício
pois, quando aquecidos, emitem luz de cor vermelha intensa.
A emissão de luz
vermelha é explicada pela:
(A)
emissão de radiação beta pelos núcleos do átomo de
estrôncio.
(B)
decomposição dos íons nitrato em nitrogênio e
oxigênio.
(C)
cor dos átomos de estrôncio metálico, que é vermelha.
(D)
transição de níveis de energia de elétrons do
estrôncio.
(E)
alta solubilidade dos compostos de estrôncio em
água.
NÚMERO ATÔMICO, NÚMERO DE MASSA E ELEMENTO QUÍMICO
1º) O núcleo atômico
I. tem volume
praticamente igual ao do átomo.
II. é eletricamente neutro.
III. contém prótons e nêutrons.
É correto o
que se afirma APENAS em
(A)
I.
(B)
II.
(C)
III.
(D)
I e II.
(E)
II e III.
2º) O número de prótons e o número de elétrons do íon estrôncio no nitrato de estrôncio são, respectivamente,
2º) O número de prótons e o número de elétrons do íon estrôncio no nitrato de estrôncio são, respectivamente,
(A) 36 e 38.
(B) 37 e 38.
(C) 38 e 38.
(D) 38 e 37.
(E) 38 e 36.
DENSIDADE DE LÍQUIDOS
1º) Uma forma de verificar se o álcool comercializado em
postos de abastecimento de combustíveis foi adulterado com adição de água é
coletar uma amostra do combustível e
(A)
determinar a sua densidade com um densímetro.
(B) medir o seu volume
com um balão volumétrico.
(C) determinar sua
massa em uma balança analítica.
(D) observar se ela
muda a cor do papel de tornassol.
(E) submetê-la a uma
filtração com papel de filtro.
quarta-feira, 1 de novembro de 2017
HISTÓRIA DA QUIMICA
1º) O “nascimento” da chamada “Química Moderna” está
diretamente relacionado com a publicação da obra Traité Élémentaire de Chimie (Tratado Elementar de Química),
escrita por
(A) Boyle.
(B) Lavoisier.
(C) Dalton.
(D) Wöhler.
(E) Berzelius.
RESPOSTA: Traité élémentaire de chimie (tratado elementar de química) é um livro texto escrito por Antoine Lavoisier e publicado em 1789.[1] [2]A obra é considerada o primeiro livro texto de química devido ao uso sistemático de instrumentos de precisão, metodologia rigorosa nos experimentos e por negar a teoria do flogisto postulado pela alquimia. O livro também contém uma tabela com os 33 elementos assim definidos por Lavoisier na época assim como uma definição de substância simples que foi fundamental para o desenvolvimento da química.[3][4]
terça-feira, 24 de outubro de 2017
TABELA PERIÓDICA
1º) Comparando átomos dos elementos Nitrogênio e Flúor no estado fundamental, pode-se afirmar que:
a) Estão no mesmo período da tabela periódica.
b) Tem o mesmo numero de elétrons de valência.
c) Tem a mesma eletronegatividade.
d) Tem a mesma carga nuclear.
e) Estão no mesmo grupo da tabela periódica.
a) Estão no mesmo período da tabela periódica.
b) Tem o mesmo numero de elétrons de valência.
c) Tem a mesma eletronegatividade.
d) Tem a mesma carga nuclear.
e) Estão no mesmo grupo da tabela periódica.
quinta-feira, 12 de outubro de 2017
TRANSFORMAÇÃO QUÍMICA DA MATÉRIA
1º) Assinale a alternativa que destaca CORRETAMENTE, o processo de obtenção de energia que envolve
transformação química da matéria.
a) Usina termoelétrica movida a gás natural.
b) Usina hidroelétrica movida a vapor d’água.
c) Usina hidroelétrica que usa água represada.
d) Usina nuclear.
e) Usina eólica.
a) Usina termoelétrica movida a gás natural.
b) Usina hidroelétrica movida a vapor d’água.
c) Usina hidroelétrica que usa água represada.
d) Usina nuclear.
e) Usina eólica.
ESTADO FÍSICO DA MATÉRIA
1º) Pode-se afirmar, CORRETAMENTE, o que mais contribui para que uma substância se encontre em um
dado estado físico é:
a) Sua constituição atômica e seu ponto de fusão ou vaporização.
b) Constituição química e substância em que ela pode se dissolver.
c) Sua pressão de vapor nas CNTP e ligações intramolecular.
d) Sua constituição atômica e pressão de vapor nas CNTP.
e) Sua constituição química e ligações intermoleculares.
a) Sua constituição atômica e seu ponto de fusão ou vaporização.
b) Constituição química e substância em que ela pode se dissolver.
c) Sua pressão de vapor nas CNTP e ligações intramolecular.
d) Sua constituição atômica e pressão de vapor nas CNTP.
e) Sua constituição química e ligações intermoleculares.
PROPRIEDADES DA MATÉRIA
1º) O universo é constituído de muitos tipos de matéria e todas as diferentes formas de matéria apresentam
propriedades. Marque a alternativa que lista, CORRETAMENTE, propriedades encontradas em todas as
matérias.
a) Temperatura, volume e cor.
b) Cor, volume e densidade.
c) Massa, volume e densidade.
d) Massa, densidade e cheiro.
e) Cheiro, temperatura e densidade.
a) Temperatura, volume e cor.
b) Cor, volume e densidade.
c) Massa, volume e densidade.
d) Massa, densidade e cheiro.
e) Cheiro, temperatura e densidade.
quinta-feira, 24 de agosto de 2017
ÁREAS DE FIGURAS GEOMÉTRICAS PLANAS
ÁREA DO LOSANGO
ÁREA DO TRAPÉZIO
(UPE 2012) A logomarca de um fabricante de automóveis é formada por dois losangos cujas diagonais se interceptam no mesmo ponto. A partir dessa logomarca, foi feita a rotação de 90° do losango maior em que dois pares de vértices são coincidentes, como mostra a figura a seguir:
Sendo “A” a medida da área da parte pintada da logomarca, a medida da área da parte pintada da
figura obtida pela rotação do losango maior é
a) 2A
b) 3A/2
c) A
d) A/2
e) A/3
terça-feira, 15 de agosto de 2017
DENSIDADE
1º) (UFPE-93)
Em um béquer com 100 mL de água, são colocados 20 ml de óleo vegetal, um cubo
de gelo e uma barra retangular de alumínio. Qual das figuras melhor representa
a aparência dessa mistura?
terça-feira, 8 de agosto de 2017
SUBSTÂNCIAS PURAS E MISTURAS
1º) (COVEST 93) Marque a afirmativa falsa.
a) Água potável é uma substância pura composta pelos elementos químicos Hidrogênio e Oxigênio, na proporção 2:1.
b) Ar puro é uma mistura homogênea de substâncias no estado gasoso, com predominância de nitrogênio
c) Água mineral é uma solução de diversos sais, entre eles: cloretos, sulfatos, carbonatos etc.
d) Granito é uma mistura heterogênea e polifásica.
e) Quando se diz que a umidade relativa do ar é 99%, isto significa que a concentração de vapor da água, presente no ar é 99% do valor de saturação.
COMENTÁRIO: ÁGUA POTÁVEL é a água de qualidade suficiente para se beber e preparar alimentos. É UMA MISTURA HOMOGÊNEA DE SAIS SULFATOS E CLORETOS, E NÃO UMA SUBSTANCIA PURA.
2º) Entre os materiais que nos cercam há aqueles que são considerados substâncias químicas e aqueles que são considerados misturas de substâncias químicas. Exemplos dessas duas classes de materiais são, respectivamente,
(A) gasolina e petróleo.
(B) água mineral e água do mar.
(C) açúcar refinado e caldo de cana.
(D) manteiga e leite de vaca.
a) Água potável é uma substância pura composta pelos elementos químicos Hidrogênio e Oxigênio, na proporção 2:1.
b) Ar puro é uma mistura homogênea de substâncias no estado gasoso, com predominância de nitrogênio
c) Água mineral é uma solução de diversos sais, entre eles: cloretos, sulfatos, carbonatos etc.
d) Granito é uma mistura heterogênea e polifásica.
e) Quando se diz que a umidade relativa do ar é 99%, isto significa que a concentração de vapor da água, presente no ar é 99% do valor de saturação.
COMENTÁRIO: ÁGUA POTÁVEL é a água de qualidade suficiente para se beber e preparar alimentos. É UMA MISTURA HOMOGÊNEA DE SAIS SULFATOS E CLORETOS, E NÃO UMA SUBSTANCIA PURA.
2º) Entre os materiais que nos cercam há aqueles que são considerados substâncias químicas e aqueles que são considerados misturas de substâncias químicas. Exemplos dessas duas classes de materiais são, respectivamente,
(A) gasolina e petróleo.
(B) água mineral e água do mar.
(C) açúcar refinado e caldo de cana.
(D) manteiga e leite de vaca.
(E) carbono e dióxido
de carbono.
quinta-feira, 3 de agosto de 2017
PLANIFICAÇÃO DE FIGURAS GEOMÉTRICAS
1º) (ENEM 2015) Uma empresa que embala seus produtos em
caixas de papelão, na forma de hexaedro regular, deseja que seu logotipo seja
impresso nas faces opostas pintadas de cinza, conforme a figura:
A gráfica que fará as impressões
dos logotipos apresentou as seguintes
sugestões planificados:
Que opção sugerida pela gráfica
atende ao desejo da empresa?
a) I
b) II
c) III
d) IV
e) V
2º) (ENEM 2012) Maria quer inovar
sua loja de embalagens e decidiu vender caixas com diferentes formatos. Nas
imagens apresentadas estão as planificações dessas caixas.
Quais serão
os sólidos geométricos que Maria obterá a partir dessas planificações?
a) Cilindro,
prisma de base pentagonal e pirâmide
b) Cone,
prisma de base pentagonal e pirâmide
c) Cone,
tronco de pirâmide e prisma
d) Cilindro,
tronco de pirâmide e prisma
e) Cilindro,
prisma e tronco de cone
quinta-feira, 29 de junho de 2017
ANÁLISE COMBINATÓRIA
PRINCÍPIO FUNDAMENTAL DA CONTAGEM.
1º) (Faap-SP) Num hospital existem 3 portas de entrada que dão para um amplo saguão no qual existem 5 elevadores. Um visitante deve se dirigir ao 6º andar utilizando-se um dos elevadores. De quantas maneiras diferentes poderá fazê-lo?
a) 5
b) 10
c) 15
d) 20
e) 30
2º) (FGV-SP) Um restaurante oferece no cardápio 2 saladas distintas, 4 tipos de pratos de carne, 5 variedades de bebidas e 3 sobremesas diferentes. Uma pessoa deseja uma salada, um prato de carne, uma bebida e uma sobremesa. De quantas maneiras diferentes a pessoa poderá fazer o seu pedido ?
a) 120
b) 110
c) 130
d) 140
e) 150
3º)
1º) (Faap-SP) Num hospital existem 3 portas de entrada que dão para um amplo saguão no qual existem 5 elevadores. Um visitante deve se dirigir ao 6º andar utilizando-se um dos elevadores. De quantas maneiras diferentes poderá fazê-lo?
a) 5
b) 10
c) 15
d) 20
e) 30
2º) (FGV-SP) Um restaurante oferece no cardápio 2 saladas distintas, 4 tipos de pratos de carne, 5 variedades de bebidas e 3 sobremesas diferentes. Uma pessoa deseja uma salada, um prato de carne, uma bebida e uma sobremesa. De quantas maneiras diferentes a pessoa poderá fazer o seu pedido ?
a) 120
b) 110
c) 130
d) 140
e) 150
3º)
sábado, 20 de maio de 2017
GEOMETRIA ESPACIAL
VOLUME DO PARALELEPIPEDO
1º) (ENEM 2012) Alguns objetos, durante a sua fabricação, necessitam passar por um processo de resfriamento. Para que isso ocorra, uma fabrica utiliza um tanque de resfriamento, como mostrado na figura.
O que aconteceria com o nível da água se colocássemos no tanque um objeto cujo volume fosse de 2400 cm3?
e) O nível subiria 20cm, fazendo a água
transbordar
RESPOSTAS:
bom, vamos ao seguinte raciocínio, se eu acrescentar qualquer objeto dentro do liquido a unica dimensão que vai variar é a altura. portanto vamos calcular a altura variada para um volume de 2400 cm3 . como nos ja sabemos a formula do volume do paralelepípedo é V=a.b.c, onde a=40 cm
b= 30 cm e c= x; logo para V= 2400 cm3 teremos: 2400=40.30.x
2400=1200x , logo x=2400/1200 x=2cm. isso acarretara um aumento de 2cm ao volume do liquido que era de 20 cm logo passara a 22 cm. letra c.
PIRÂMIDES
1º) (ENEM 2012) Alguns objetos, durante a sua fabricação, necessitam passar por um processo de resfriamento. Para que isso ocorra, uma fabrica utiliza um tanque de resfriamento, como mostrado na figura.
O que aconteceria com o nível da água se colocássemos no tanque um objeto cujo volume fosse de 2400 cm3?
a) O nível subiria 0,2cm,
fazendo a água ficar com 20,2cm de altura.
b) O nível subiria 1cm,
fazendo a água ficar com 21cm de altura.
c) O nível subiria 2cm,
fazendo a água ficar com 22cm de altura.
d) O nível subiria 8cm,
fazendo a água transbordar.
RESPOSTAS:
bom, vamos ao seguinte raciocínio, se eu acrescentar qualquer objeto dentro do liquido a unica dimensão que vai variar é a altura. portanto vamos calcular a altura variada para um volume de 2400 cm3 . como nos ja sabemos a formula do volume do paralelepípedo é V=a.b.c, onde a=40 cm
b= 30 cm e c= x; logo para V= 2400 cm3 teremos: 2400=40.30.x
2400=1200x , logo x=2400/1200 x=2cm. isso acarretara um aumento de 2cm ao volume do liquido que era de 20 cm logo passara a 22 cm. letra c.
PIRÂMIDES
1º)(IFPE- 2013) São maravilhas do mundo antigo as grandes pirâmides de Gizé: Quéops, Quéfren e Miquerinos. A pirâmide de Quéops, também conhecida como a Grande Pirâmide, foi construída para ser a tumba do Faraó Quéops da quarta dinastia egípcia. Ela é a maior das três pirâmides de Gizé, sua altura original era de 146,60 metros, mas atualmente é de 137,16 metros, pois falta parte do seu topo e do
revestimento. A base da Grande Pirâmide é um quadrado com aproximadamente 230 metros de lado. A
pirâmide de Quéops é o monumento mais pesado que já foi construído pelo homem.
Uma escola resolve construir um réplica da pirâmide de Quéops próxima ao laboratório de História. As
dimensões da réplica são 9 metros de altura e o quadrado da base tem 14,13 metros de lado. Qual é o
inteiro mais próximo do volume, em metros cúbicos, da réplica da pirâmide de Quéops construída pela
escola ?
a) 591
b) 593
c) 595
d) 597
e) 599
CILINDRO
Volume do cilíndro
1º) (ENEM 2011) É possível usar água ou comida para atrair as aves e observá-las. Muitas pessoas costumam usar água com açúcar, por exemplo, para atrair beija-flores. Mas é importante saber que, na hora de fazer a mistura, você deve sempre usar uma parte de açúcar para cinco partes de água. Além disso, em dias quentes, precisa trocar a água de duas a três vezes, pois com o calor ela pode fermentar e, se for ingerida pela ave, pode deixa-́la doente. O excesso de açúcar, ao cristalizar, também pode manter o bico da ave fechado, impedindo-a de se alimentar. Isso pode até mata-́la.
Ciência Hoje das Crianças. FNDE; Instituto Ciência Hoje, ano 19, no 166, mar. 1996.
Pretende-se encher completamente um copo com a mistura para atrair beija-flores. O copo tem formato cilíndrico, e suas medidas são 10 cm de altura e 4 cm de diâmetro. A quantidade de água que deve ser utilizada na mistura é cerca de (utilize π = 3)
A) 20 mL.
B) 24 mL.
C) 100 mL.
D) 120 mL.
E) 600 mL.
CONE
1º) (ENEM 2010) Um arquiteto está fazendo um projeto de iluminação de ambiente e necessita saber a altura que deverá instalar a luminária ilustrada na figura.
Sabendo-se que a luminária deverá iluminar uma área circular de 28,26m2, considerando p = 3,14, a altura h será igual a:
RESPOSTA:
2º) (ENEM 2011) A figura seguinte mostra um modelo de sombrinha muito usado em países orientais
Disponível em: http://mdmat.psico.ufrgs.br. Acesso em: 1 maio 2010. Esta figura é uma representação de uma superfície de revolução chamada de
A) pirâmide.
B) semiesfera.
C) cilindro.
D) tronco de cone.
E) cone.
TRONCO DO CONE
Volume do cilíndro
1º) (ENEM 2011) É possível usar água ou comida para atrair as aves e observá-las. Muitas pessoas costumam usar água com açúcar, por exemplo, para atrair beija-flores. Mas é importante saber que, na hora de fazer a mistura, você deve sempre usar uma parte de açúcar para cinco partes de água. Além disso, em dias quentes, precisa trocar a água de duas a três vezes, pois com o calor ela pode fermentar e, se for ingerida pela ave, pode deixa-́la doente. O excesso de açúcar, ao cristalizar, também pode manter o bico da ave fechado, impedindo-a de se alimentar. Isso pode até mata-́la.
Ciência Hoje das Crianças. FNDE; Instituto Ciência Hoje, ano 19, no 166, mar. 1996.
Pretende-se encher completamente um copo com a mistura para atrair beija-flores. O copo tem formato cilíndrico, e suas medidas são 10 cm de altura e 4 cm de diâmetro. A quantidade de água que deve ser utilizada na mistura é cerca de (utilize π = 3)
A) 20 mL.
B) 24 mL.
C) 100 mL.
D) 120 mL.
E) 600 mL.
CONE
1º) (ENEM 2010) Um arquiteto está fazendo um projeto de iluminação de ambiente e necessita saber a altura que deverá instalar a luminária ilustrada na figura.
Sabendo-se que a luminária deverá iluminar uma área circular de 28,26m2, considerando p = 3,14, a altura h será igual a:
a) 3 m b) 4 m c) 5 m d) 9 m e) 16 m
RESPOSTA:
2º) (ENEM 2011) A figura seguinte mostra um modelo de sombrinha muito usado em países orientais
Disponível em: http://mdmat.psico.ufrgs.br. Acesso em: 1 maio 2010. Esta figura é uma representação de uma superfície de revolução chamada de
A) pirâmide.
B) semiesfera.
C) cilindro.
D) tronco de cone.
E) cone.
TRONCO DO CONE
1º) (ENEM 2013) Uma cozinheira, especialista em fazer bolos, utiliza uma forma no formato representado na figura:
Nela identifica-se a representação de duas figuras geométricas tridimensionais. Essas figuras são
a) um tronco de cone e um cilindro.
b) um cone e um cilindro.
c) um tronco de pirâmide e um cilindro.
d) dois troncos de cone.
e) dois cilindros
RESPOSTAS:
LETRA D: podemos observar dois cones, um maior e outro menor, onde ambos sofreram uma intersecção de um plano paralelo a suas bases circulares.
Assinar:
Postagens (Atom)